In questi giorni mi sono voluto dilettare con alcune letture stimolanti, di carattere tecnico, su un argomento assai sentito negli ambienti nautici ma che, di riflesso, credo interessi abbastanza anche noi. Mi riferisco alla corrosione galvanica. E' un fenomeno chimico-fisico che consiste essenzialmente nella corrosione di un metallo quando lo si mette a contatto con un altro metallo più nobile in ambiente umido. In particolare, in giro per la Rete si trovano siti di un certo livello (universitario) che trattano tale argomento, con riferimento agli acciai ma anche all'alluminio. Le nostre antenne sono generalmente in lega di alluminio e le minuterie in ferro zincato o in acciaio inox.
Gli ambienti in cui tali antenne risultano immerse sono più o meno inquinati e , se in prossimità del mare, molto ricchi di cloruri.
Cosa succede alla lega di alluminio delle antenne in corrispondenza delle unioni con bulloni o altri pezzi speciali in acciaio inox o ferro zincato ?
Quale è il migliore accoppiamento ai fini della prevenzione della corrosione galvanica ? Conviene sempre usare minuterie in inox ?
Per ora ho voluto fare una prova sperimantale molto semplice, che chiunque può replicare. Ci si procura un contenitore di acqua , la si arricchisce con del sale da cucina (buon elettrolita in acqua), ottenendo così una soluzione acquosa salina buona conduttrice di elettricità. Ci si procura un buon voltmeptro-amperometro analogico in grado di misurare piccole correnti e tensioni. Io ho usato l'intramontabile ICE.
A questo punto si immergono nella soluzione i pezzi metallici, due per volta, uno in lega di alluminio per antenne, uno in acciaio inox AISI316 (alias A4, usato in ambienti marini), uno in ferro zincato e uno in rame.
In particolare, si immergerà quello in alluminio e lo si lascerà sempre immerso perchè vogliamo studiare il fenomeno della corrosione galvanica proprio di tale metallo. Poi si immerge, ad esempio, il pezzo di rame. Si collegano i puntali dell'amperometro ai due elettrodi immersi in soluzione e si regola la portata dello strumento in mA per evitare che l'ago vada a sbattere a fondo scala. E' bello vedere salire bruscamente l'ago, a indicare l'instaurarsi di una corrente all'interno della soluzione acquosa salina
Questo sta a significare che degli elettroni si staccano dal metallo meno nobile (l'alluminio) per migrare verso quello più nobile (il rame).
Si può prevedere quale dei due metalli si comporterà, come si suol dire, da donatore (anodo) di elettroni e quale da ricettore (catodo) grazie alla serie o scala galvanica dei metalli e leghe in acqua di mare.
La prima foto riportata sotto illustra proprio il caso dell'accoppiata alluminio-rame.
Se ora sotituiamo l'elettrodo in rame con il pezzo di acciaio inox A4 (un comune bullone), vediamo che anche in questo caso si stabilisce una corrente elettrica, ma inferiore rispetto al caso del rame. Quindi, anche nel caso di accoppiata lega di alluminio-acciaio inox c'è una certa tendenza alla corrosione galvanica della lega di alluminio. La seconda foto è quella relativa a questo caso.
Mettiamo infine in soluzione il pezzo di ferro zincato (un altro comunissimo bullone). La terza foto è relativa a questa situazione. Anche così misuriamo una corrente elettrica, ma inferiore di un ordine di grandezza rispetto a quella vista nel caso dell'acciaio inox. Che significa ?
Che in questo caso la lega di alluminio cede meno elettroni , cioè tende di meno a corrodersi. Si osservi inoltre il colore dei due fili elettrici dei due puntali. In questo caso risultano invertiti rispetto ai casi precedenti. La corrente cioè scorre in senso opposto. Questo perchè nella scala galvanica delle leghe e dei metalli in acqua di mare lo zinco sta , rispetto alla lega di alluminio, dalla parte opposta se confrontato con l'acciaio inox e il rame.
In definitiva, nell'accoppiata zinco-lega di alluminio è il primo a comportarsi da donatore di elettroni, mentre negli altri due casi a comportarsi da donatore di elettroni è la lega di alluminio. Questo spiegherebbe perchè se usiamo bulloni di ferro zincato accoppiati con la lega di alluminio, dopo un pò, a seconda anche dell'ambiente in cui si trovano, tali bulloni "arrugginiscono".
Se usiamo invece bulloni in acciaio inox, questi non si deteriorano , ma potrebbe deteriorarsi la lega di alluminio ! In ambienti nautici o professionali in genere, si cerca di scongiurare tale evenienza interponendo tra acciaio inox e lega di alluminio un materiale plastico che separi elettricamente i due metalli. E' comunque da dire che la maggiore o minore tendenza alla corrosione galvanica dipende anche dal rapporto tra la superficie del metallo meno nobile e quella del metallo più nobile. Ad esempio, un piccolo rivetto di alluminio infilato in un profilato di acciaio inox avrà vita sicuramente breve. Se invece è il pezzo di inox a presentare minore superficie rispetto alla lega di alluminio, il fenomeno della corrosione galvanica sarà meno evidente.
Gli ambienti in cui tali antenne risultano immerse sono più o meno inquinati e , se in prossimità del mare, molto ricchi di cloruri.
Cosa succede alla lega di alluminio delle antenne in corrispondenza delle unioni con bulloni o altri pezzi speciali in acciaio inox o ferro zincato ?
Quale è il migliore accoppiamento ai fini della prevenzione della corrosione galvanica ? Conviene sempre usare minuterie in inox ?
Per ora ho voluto fare una prova sperimantale molto semplice, che chiunque può replicare. Ci si procura un contenitore di acqua , la si arricchisce con del sale da cucina (buon elettrolita in acqua), ottenendo così una soluzione acquosa salina buona conduttrice di elettricità. Ci si procura un buon voltmeptro-amperometro analogico in grado di misurare piccole correnti e tensioni. Io ho usato l'intramontabile ICE.
A questo punto si immergono nella soluzione i pezzi metallici, due per volta, uno in lega di alluminio per antenne, uno in acciaio inox AISI316 (alias A4, usato in ambienti marini), uno in ferro zincato e uno in rame.
In particolare, si immergerà quello in alluminio e lo si lascerà sempre immerso perchè vogliamo studiare il fenomeno della corrosione galvanica proprio di tale metallo. Poi si immerge, ad esempio, il pezzo di rame. Si collegano i puntali dell'amperometro ai due elettrodi immersi in soluzione e si regola la portata dello strumento in mA per evitare che l'ago vada a sbattere a fondo scala. E' bello vedere salire bruscamente l'ago, a indicare l'instaurarsi di una corrente all'interno della soluzione acquosa salina

Questo sta a significare che degli elettroni si staccano dal metallo meno nobile (l'alluminio) per migrare verso quello più nobile (il rame).
Si può prevedere quale dei due metalli si comporterà, come si suol dire, da donatore (anodo) di elettroni e quale da ricettore (catodo) grazie alla serie o scala galvanica dei metalli e leghe in acqua di mare.
La prima foto riportata sotto illustra proprio il caso dell'accoppiata alluminio-rame.
Se ora sotituiamo l'elettrodo in rame con il pezzo di acciaio inox A4 (un comune bullone), vediamo che anche in questo caso si stabilisce una corrente elettrica, ma inferiore rispetto al caso del rame. Quindi, anche nel caso di accoppiata lega di alluminio-acciaio inox c'è una certa tendenza alla corrosione galvanica della lega di alluminio. La seconda foto è quella relativa a questo caso.
Mettiamo infine in soluzione il pezzo di ferro zincato (un altro comunissimo bullone). La terza foto è relativa a questa situazione. Anche così misuriamo una corrente elettrica, ma inferiore di un ordine di grandezza rispetto a quella vista nel caso dell'acciaio inox. Che significa ?
Che in questo caso la lega di alluminio cede meno elettroni , cioè tende di meno a corrodersi. Si osservi inoltre il colore dei due fili elettrici dei due puntali. In questo caso risultano invertiti rispetto ai casi precedenti. La corrente cioè scorre in senso opposto. Questo perchè nella scala galvanica delle leghe e dei metalli in acqua di mare lo zinco sta , rispetto alla lega di alluminio, dalla parte opposta se confrontato con l'acciaio inox e il rame.
In definitiva, nell'accoppiata zinco-lega di alluminio è il primo a comportarsi da donatore di elettroni, mentre negli altri due casi a comportarsi da donatore di elettroni è la lega di alluminio. Questo spiegherebbe perchè se usiamo bulloni di ferro zincato accoppiati con la lega di alluminio, dopo un pò, a seconda anche dell'ambiente in cui si trovano, tali bulloni "arrugginiscono".
Se usiamo invece bulloni in acciaio inox, questi non si deteriorano , ma potrebbe deteriorarsi la lega di alluminio ! In ambienti nautici o professionali in genere, si cerca di scongiurare tale evenienza interponendo tra acciaio inox e lega di alluminio un materiale plastico che separi elettricamente i due metalli. E' comunque da dire che la maggiore o minore tendenza alla corrosione galvanica dipende anche dal rapporto tra la superficie del metallo meno nobile e quella del metallo più nobile. Ad esempio, un piccolo rivetto di alluminio infilato in un profilato di acciaio inox avrà vita sicuramente breve. Se invece è il pezzo di inox a presentare minore superficie rispetto alla lega di alluminio, il fenomeno della corrosione galvanica sarà meno evidente.
 Credo che due metalli uguali (o non molto dissimili, trattandosi pur sempre di leghe) non debbano presentare fenomeni apprezzabili di corrosione galvanica, o mi sbaglio?
Credo che due metalli uguali (o non molto dissimili, trattandosi pur sempre di leghe) non debbano presentare fenomeni apprezzabili di corrosione galvanica, o mi sbaglio? 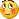


 rimarrò senza boom o ancora peggio, tra qualche anno troverò l'antenna spiattellata al suolo?
rimarrò senza boom o ancora peggio, tra qualche anno troverò l'antenna spiattellata al suolo? 

Commenta